Обработка воды в циркуляционных системах охлаждения
В замкнутых циркуляционных системах охлаждения, где в качестве охлаждающего агента выступает вода, всегда присутствует необходимость поддерживать определенный водно-химический режим. Обусловлено это тем, что аппараты и трубопроводы при ненадлежащем качестве охлаждающей воды подвергаются различного рода воздействиям, таким как:
- Коррозии металла;
- Образованию накипных отложений на поверхностях нагрева;
- Биологическому обрастанию;
- Зашламляемости окислами железа и взвешенными веществами;
Защита металла от коррозии и способы ее предупреждения
Причиной, вызывающей коррозию металла, является наличие в воде растворенного кислорода, свободной углекислоты, хлоридов, нитратов и сульфатов. Усиление коррозийного воздействия данных примесей на металл происходит при повышении температуры и снижению величины pH.
Для определения того, насколько коррозийно воздействие воды на металл (чугун или сталь), пользуются рассчитанным для данной воды индексом Ризнера ((ИР), (индексом стабильности)) и индексом Ланжелье (индексом насыщения карбонатом кальция). Первый более точно подходит для определения возможной коррозии, второй для выявления образования карбонатных отложений. Расчет индексов ведется на основании данных о жесткости воды, щелочности, pH, температуре и минерализации. Расчет индексов рассмотрен ниже.
В процессе коррозии происходит разрушение стенок аппаратов и трубопроводов с образованием бугристых отложений, которые оказывают дополнительное сопротивление потоку воды, снижают напор и, как следствие, количество подаваемой воды насосами.
Коррозия латунных трубок холодильных аппаратов возникает вследствие обесцинкования их поверхности. Это связано с повышенным содержанием в воде хлоридов в случае использования морской воды, и свободной углекислоты и сероводорода в случае пресной.
Для борьбы с коррозией в замкнутых циркуляционных системах охлаждения наибольшее применение получила практика ввода в воду ингибиторов коррозии. Их действие основано на том, что в определенных условиях они образуют на поверхности металла тонкую защитную пленку, затрудняющую или вовсе останавливающую процесс коррозии.
В качестве ингибиторов коррозии для замкнутых систем охлаждения применяются гексаметафосфат натрия, полифосфаты, фосфор содержащие кислоты: оксиэтилидендифосфоновая кислота (ОЭДФ), нитрилотриметилфосфоновая кислота (НТФ), 2-фосфонобутан-1,2,4-трикарбоновая кислота (ФБТК), хроматы и бихроматы.
Для жесткой воды в качестве ингибиторов коррозии могут использоваться комплексоны, такие как этилендиаминтетрауксусная кислота (ЭДТА), нитрилотриуксусная кислота (НТА). Комплексоны образуют тонкую пленку, вступая в реакцию с Са2+ и Mg2+.
Борьба с накипными отложениями и способы предотвращения их образований
Основным соединением, имеющим наибольшее процентное содержание в составе накипи, является карбонат кальция. Образование карбоната кальция происходит в результате распада бикарбонатных ионов по следующей схеме:
| 2HCO3- ↔ | CO32- + CO2 + H2O |
| + | |
| Ca2+ | |
| ↑↓ | |
| СаСО3 в растворе | |
| ↑↓ | |
| СаСО3 пересыщенный раствор | |
| ↑↓ | |
| СаСО3 кристаллы |
Распаду бикарбонат-иона способствуют увеличение температуры и потери свободной углекислоты при разбрызгивании воды в градирнях. Увеличение концентрации карбонат-иона в присутствии катионов кальция приводит к образованию карбоната кальция – малорастворимого соединения, формирующего плотные отложения на стенках трубопроводов и аппаратов.
В состав кальциевой накипи также может входить незначительное количество гидроксида магния, с основном не более 1%. Гидроксид магния выпадает в осадок при достижении значений рН выше 10.
Образование отложений сульфата кальция возможно в воде с довольно высокими показателями по солесодержанию катионов кальция и сульфат-анионов. Одной из причин возникновения данных условий является сокращение добавок свежей воды.
Выделение сульфата кальция из раствора происходит с образованием дигидрата CaSO4⋅2H2O, полугидрата 2CaSO4⋅2H2O и ангидрида CaSO4. Эти соединения имеют разную растворимость, обуславливающую состав сульфато-кальциевых отложений.
Для определения способности воды выделять из раствора кальциевые отложения пользуются индексом Ланжелье (J), или индексом насыщения карбонатом кальция. Данный индекс указывает, насколько стабильна вода и будет ли в ней выпадать осадок карбоната кальция.
При J = 0 вода стабильна и осадок выпадать не будет, при J > 0 возникает риск образования карбонатно-кальциевых отложений, при J < 0 начинается коррозия оборудования.
По индексу Ризнера характеристики воды буду следующими:
ИР = 4÷5 – наблюдаются большие карбонатно кальциевые отложения;
ИР = 5÷6 – слабые карбонатно кальциевые отложения;
6 < ИР < 7 – вода стабильна, может наблюдаться незначительная коррозия;
ИР = 7÷9 – высокая коррозийная активность воды;
ИР > 9 – критическая коррозия.
Индекс Ризнера имеет смысл рассчитывать при кислород насыщении воды от 4 мг/л. В противном случае образование защитной карбонатной пленки не происходит, и металл от коррозийного воздействия не защищен.
Для расчета индексов Ланжелье и Ризнера необходимо знать фактический показатель pHф данной воды при ее нагреве в холодильнике до температуры t, и pHs – показатель в случае равновесного насыщения исследуемой воды карбонатом кальция, при котором она не обладала бы способностью выделять или растворять карбонат кальция. Для расчета pHs необходимо пользоваться таблицей Ланжелье и знать общую щелочность воды, концентрацию кальция, общее солесодержание и температуру предполагаемого нагрева:
J = pHф – pHs;
ИР = 2pHs – pHф.
pHs = f1(t) – f2(Ca2+) – f3(Щ) + f4(P), где
f1(t) – функция температуры нагрева,
f2(Ca2+) – функция содержания кальция,
f3(Щ) – функция щелочности,
f4(P) – функция общей минерализации.
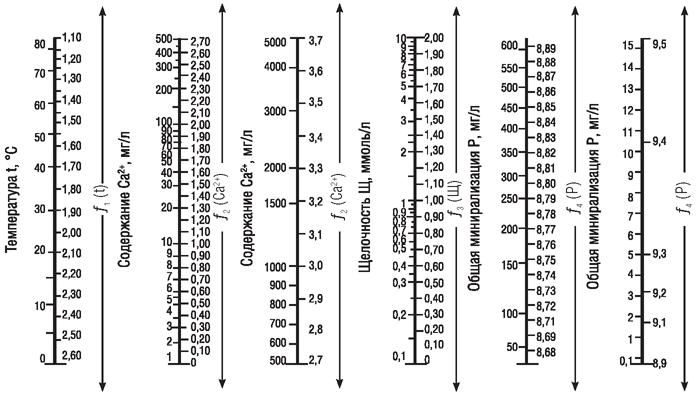 График для определения pHs
График для определения pHs
При положительном индексе насыщения наблюдается тенденция воды к накипеобразованию. Этот факт указывает на необходимость предварительной подготовки и последующей стабилизационной обработки воды для исключения образования накипных отложений.
- К методам предварительной подготовки воды для предупреждения карбонатно-кальциевых отложений относятся такие, как:
- умягчение воды на катионнообменных фильтрах;
- обессоливание на установке обратного осмоса.
- Стабилизационная обработка воды осуществляется такими способами, как:
- подкисление;
- фосфатирование.
Подкисление происходит с выделением свободной углекислоты, снижением щелочности воды и переводом карбонатной жесткости в некарбонатную:
Ca(HCO3)2 + H2SO4 → CaSO4 + CO2↑ + 2H2O.
Для наилучшего выделения углекислоты ввод кислоты следует осуществлять вместе с добавочной водой перед насосами и холодильниками.
В случае же коррозийного воздействия углекислоты на аппараты и трубопроводы ввод кислоты рекомендуется осуществлять перед градирней. В таком случае происходит удаление свободной углекислоты и стабилизация проходит за счет снижения щелочности.
Следует принять во внимание, что дозирование серной кислоты должно строго контролироваться, т.к. при ее избытке возможна коррозия оборудования, при недостатке выпадение в осадок карбоната кальция. Дозировка должна осуществляться таким образом, что бы на поверхности металла всегда присутствовала тонкая защитная пленка карбоната кальция.
В условиях высокой щелочности ввод серной кислоты нежелателен, так как при этом возрастает концентрация сульфатов и в осадок может выпадать сульфат кальция.
Фосфатирование воды имеет целью создать такие условия, которые препятствовали бы кристаллизации карбонатно-кальциевых соединений с последующим их отложением в виде твердых образований на стенках труб и аппаратов.
Для фосфатирования охлаждающей воды применяют тринатрийфосфат (Na3PO4⋅12H2O), гексаметафосфат натрия (NaPO3)6, триполифосфат (Na5P3O10) и органические фосфонаты и композиционные соединения на их основе.
Действие тринатрийфосфата (Na3PO4⋅12H2O) основано на переводе кристаллизационных образований карбоната кальция в ортофосфат кальция, не прикипающий и легко удаляемый шлам. Образующийся ортофосфат кальция адсорбируется на гранях кристаллов карбоната кальция, изменяет их структуру и препятствует их дальнейшему росту. В результате образуется шлам, который можно легко удалить при продувке системы.
Гексаметафосфат натрия ((NaPO3)6)препятствует росту кристаллов карбоната кальция и увеличивает его растворимость. Данное действие обусловлено адсорбционным проявлением гексаметафосфата натрия и кальция по отношению к кристаллам карбоната кальция. Образуя тонкую пленку, гексаметафосфат тормозит дальнейшее укрупнение кристаллов, что позволяет прекратить процесс формирования накипных отложений.
Триполифосфат (Na5P3O10) в воде разлагается, образуя тринатрийфосфат.
Применение гексаметафосфата и триполифосфата целесообразно при одновременном введении в воду соды NaHCO3 или Na2CO3 или щелочи NaOH с целью повышения pH, т.к. данные фосфаты имеют кислую реакцию.
Органические фосфонаты, являющиеся производными фосфорной кислоты, и композиционные соединения на их основе предотвращают процесс солеотложения на основе явления порогового эффекта: при незначительных концентрациях они стабилизируют насыщенные растворы солей жесткости и препятствуют образованию отложений кальция и магния.
Применение оксиэтилидендифосфоновой кислоты (ОЭДФ) и нитрилотриметилфосфоновой кислоты (НТФ) способно предотвратить образование карбонатнокальциевых отложений при жёсткости воды до 10 мг-экв/л и температурой нагрева до 50 0С. Дозы ОЭДФ и НТФ намного ниже стехиометрических и, в зависимости от карбонатной жесткости, составляют от 0,5 до 5,0 мг/л.
Фосфатирование воды должно вестись из того расчета, что концентрация фосфатов в системе в пересчете на P2O5 должна находиться в пределах 1 – 2 мг/л. Такая концентрация фосфатов будет способствовать предупреждению образования карбонатных отложения. При больших концентрациях начнется умягчение воды и выпадение шлама.
Готовка растворов фосфатов должна осуществляться при использовании коррозийно защищенного оборудования. Дозировку тринатрийфосфата и триполифосфата следует проводить в виде растворов крепостью не более 0,1 - 0,2 %, а гексаметафосфата не более 3 % во избежание умягчения воды в точке ввода реагентов.
Фосфатирование воды связано с увеличением щелочности. Наибольшая щелочность может быть рассчитана по формуле:
Щц = b1 – 0,15 ⋅ Жн, где
Щц – предельная щелочность циркуляционной воды при фосфатном режиме, мг-экв/л;
Жн – некарбонатная жесткость подпиточной воды, мг-экв/л;
b1 в случае обработки воды тринатрийфосфатом принимается равным 5 мг-экв/л, в случае гексаметафосфата 6 мг-экв/л.
Для поддержки щелочности, не превышающей Щц, систему необходимо подвергать периодической продувке q3:
q3 = (Щп ⋅ q1 / Щц – Щп) – q2, где
q1 – потеря воды при испарении на градирне, %;
q2 – потеря воды при уносе;
Щп – щелочность подпиточной воды, мг-экв/л.
Примерные потери воды на испарение можно определить с учетом температур воды до и после охлаждения, а также температуры воздуха в градирне и расходу воды на охлаждение:
q1 = k1 ⋅ ∆t ⋅ Q, где
k1 – коэффициент, зависящий от температуры воздуха в градирнях;
∆t – разность температуры воды до и после охлаждения, 0С;
Q – расход воды на охлаждение, м3/ч.
| Температура воздуха, 0С | 0 | 10 | 20 | 30 | 40 |
| Коэффициент, k1 | 0,001 | 0,0012 | 0,0014 | 0,0015 | 0,0016 |
В случае q2 > Щп ⋅ q1/Щц – Щд продувка системы не требуется, т.к. необходимо количество воды для поддержки нужной щелочности уносится.
Если рассчитанное количество продувочной воды велико и с экономической точки зрения мало целесообразно, продувку можно уменьшить путем добавление кислоты. Доза кислоты рассчитывается по следующей формуле:
Дк = е ⋅ (Щп – (q – q1)/q ⋅ Щц) ⋅ 100/С1, где
Дк – количество технической кислоты на 1 м3 подпилочной воды, гр.;
e – эквивалентная масса кислоты (для H2SO4 e = 49,04 мг-экв, для HCl e = 36,47 мг-экв);
C1 – содержание кислоты в техническом продукте, %;
q – расход подпиточной воды, м3/ч.
Учитывая потери при продувке системы, уноса воды и ее испарения, количество добавляемого в систему реагента рассчитывается по формуле:
Д = [ (1 ÷ 2) + 5⋅V/24⋅q] ⋅ 100/C1, где
Д - количество реагента на 1 м3 подпилочной воды, гр.;
V – объем системы с учетом всех емкостей, трубопроводов и аппаратов;
С1 – содержание P2O5 в техническом продукте, %;
q – расход подпилочной воды, м3/ч.
Удаление взвешенных веществ и железа
При высоких содержаниях железа в добавочной воде его следует удалять до поступления воды в циркуляционную систему охлаждения.
Обезжелезивание подпиточной воды может осуществляться различными методами, такими как: удаление железа на модифицированных загрузках, фильтрованием с предварительной аэрацией, отстаивание и пр.
В циркуляционных системах для удаления взвешенных веществ и железа наиболее целесообразно применять фильтры с песчаной, антрацитовой или полимерной загрузкой. Крупность зерна должна составлять 1,5 – 2,5 мм, высота фильтрующей загрузки 2,5 – 3 м, скорость фильтрования 10 – 15 м/ч.
В зависимости от концентрации взвешенных веществ в циркуляционной воде выбирают место установки фильтра: при невысоких содержаниях имеет смысл фильтровать лишь часть воды, сделав на линии разветвление. При большой загрязненности воды фильтр ставят на основную линию циркуляции, предусматривая байпас.
Борьба с биологическими обрастаниями
Борьба с биологическими обрастаниями в циркуляционных системах охлаждения ведется при помощи биоцидов – химических веществ, угнетающих жизнедеятельность микроорганизмов и предотвращающих их дальнейшее размножение.
Наиболее распространенным до недавнего времени способом борьбы с биообрастанием являлось хлорирование воды. Количество добавляемого в воду хлора должно быть пропорционально загрязненности воды и в каждом конкретном случае подбирается индивидуально из того расчета, что концентрация активного хлора в воде, выходящей из наиболее удаленного холодильного аппарата, должна составлять 0,4 – 0,5 мг/л.
Также в качестве биоцидов применяют такие химические реагенты, как гипохлорит натрия, перманганат калия, медный купорос и пр.


